Бодисын найрлага, бүтэц, тэдгээрийн хувирч өөрчлөгдөх зүй тогтлыг судалдаг ухаан.
Эртний грекийн гүн ухаантан Демокрит МЭӨ 400 жилийн тэртээ бодисын хуваагдлын хязгаар болох хамгийн жижиг хэсгийг атом гэж нэрлэжээ. Английн химич Дальтон 1808 онд атомын онолоор томьёолж бүх бодис нь шинээр бий болгож ч болохгүй , оргүй устгаж ч болохгүй , үл хуваагдагч атом хэмээх жижиг хэсгүүдээс тогтдог гэжээ. Дальтон химийн элемент бүрийн атом нь тодорхой догтмол масстай байна гэж баталж байлаа.
Орчин үеийн судалгаагаар атом нь 2 10~^м буюу 0,2 нм орчим диаметртэй , 10-27-10-25 кг орчим масстай болох нь тогтоогджээ. Түүнийг ихэвчлэнмассын атом нэгжээр /1м.а.н=1,66*10-27кг/ илэрхийлдэг .Физикчид 1900 оны орчим атом нь нарийн нийлмэл бүтэцтэй болохыг тогтоожээ . Английн эрдэмтэн Крукс 1895 онд сийрэг хий дундуур цахилгаан дамжуулдаг, сөрөг цэнэгтэй жижиг хэсгүүд катод хийсэн металлын атомаас ялгарч байгааг нээжкатодын туяа гэж нэрлэжээ.
Английн физикч Ж.Томсон катодын туяаг судлаад тэр нь сөрөг цэнэгтэй жижиг хэсгийн урсгал болохыг тогтоож тэр жижиг хэсгийг электрон гэж нэрлэжээ. Америкийн физикч Милликен 1909-1917 онуудад хийсэн туршилтаараа электрон нь 1,6*10-19 кулон цэнэгтэй 9,11.10-31 кг масстай болохыг тогтоожээ. Германы физикч Рентген 1895 онд катодын туяа нь шилэн хоолойн ханыг мөргөж шинэ маягийн туяа цацаргаж байгааг нээж X туяа гэж нэрлэжээ.
Хожим нь түүнийг ойролцоогоор 10-10м орчим урттай цахилгаан соронзон долгион болохыг тогтоосон бөгөөд рентген туяа гэж нэрлэжээ. Францын эрдэмтэн А.Беккерель 1896 онд зарим бодис үл үзэгдэх туяа цацруулдаг бөгөөд тэр туяа нь фото зургийн хальсыг харлуулж , агаарыг иончилдог болохыг нээж цацраг идэвхжил гэж нэрлэжээ. Энэ үзэгдлийг Пери Кюри, Мари Кюри нар цааш нь нарийвчлан судалжээ. Энэ туяа нь соронзон оронд гурав задардаг бөгөөд эерэг цэнэгтэйг нь альфа (α), сөрөг цэнэгтэйг бета(β), цэнэггүйг нь гамма(γ) гэж нэрлэв . Хожим α туяа нь гелийн атомын цөмийн, β туяа нь электроны урсгал, γ туяа нь цахилгаан соронзон долгион болохыг тогтоожээ.
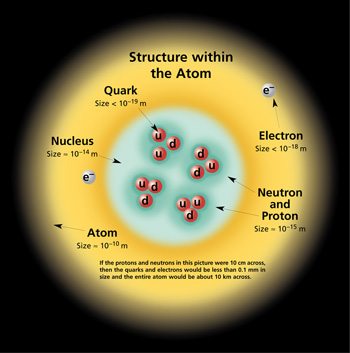
Энэ бүх баримтуудын үндсэн дээр Томсон 1898 онд атом нь цэнэгтэй хэсгүүдээс тогтдог гэсэн таамаглал дэвшүүлж 1909 онд Резерфорд Гейгер, Марсден нар нимгэн металл ялтсаар альфа (α) туяаг нэвтрүүлэх туршилт хийж судалсны дүнд атомын төвд масс ихтэй эерэг цэнэгтэй хэсэг буюу цөмтүүнийг тойрон масс багатай сөрөг цэнэгтэй хэсгүүд буюу электрон эргэлдэж байдаг гэсэн загварыг 1911 онд дэвшүүлжээ.
 |
Английн физикч Мозли янз бүрийн металлын ялгаруулж буй
рентген туяаны уртыг харьцуулан судалж түүний уртын
квадрат язгуур нь үелэх систем дэх тэр металлын дэс дугаартай нь урвуу
хамааралтай болохыг тогтоожээ. Хожим нь химийн элементийн үелэх
систем дэх дугаар нь түүний атом дахь протоны тоо буюу цөмийн
цэнэгтэй нь тэнцүү болохыг Резерфордын туслах ажилтан Чедвик
1932 онд атомын цөмдцахилгаан саармаг жижиг хэсэг нейтрон * байдгийг илрүүлжээ.
Ийнхүү атом нь цөм ба электрон бүрхүүлээс, цөм нь протон ба нейтроноос
тогтдог болох нь тодорхой болжээ.
Протон, нейтрон, электроныг нийтэд нь эгэл бөөмс , протон , нейтроныг хамтад нь нуклон гэж нэрлэдэг. Протон ба нейтроны нийлбэрийг нуклоны тообуюу массын тоо гэж нэрлэдэг.
Эгэл бөөмсийн масс ба цэнэг
Эгэл
|
Цэнэг
|
Харьцангуй
|
Масс
|
Масс
|
бөөм
|
/кулон/
|
эгэл цэнэг
|
/кг/
|
/ман/
|
Протон
|
+1.6.10"19
|
+1
|
1.67.1027
|
1,0
|
Нейтрон
|
0
|
0
|
1.67.10"27
|
1.0
|
Электрон
|
-1.6.10"19
|
-1
|
9,1.10"31
|
5,5.10
|
Ямарч атомын бүтцийн нэгжийг нуклид гэх бөгөөд түүний тэмдгийн өмнө, дээд талд нь нуклоны тоо / массын тоо /,доод талд нь протоны тоо/ дэс дугаар/ -г тэмдэглэдэг .Жишээ нь : Нүүрстөрөгчийн нуклидыг 126 С, протоныг 11р,нейтроныг 10n, а бөөмийг 42Не, электроныг °1е гэж тэмдэглэдэг . Нэг элементийн нуклидуудыг изотоп гэнэ. Изотопууд нь хоорондоо протоны тоогоороо ижил боловч нуклоны тоогоороо өөр буюу өөрөөр хэлбэл цөм дэх нейтроны тоогоороо ялгагддаг . Байгал дахь химийн элементүүд нь изотопуудын хольц учраас тэдгээрийн харьцангуй атом масс/х.а.м/ нь ихэвчлэн бутархай тоогоор илэрхийлэгддэг . Химийн элементийн химийн шинж нь атомын цөмийн цэнэг , электрон давхрааны бүтцээс голлон хамаарах бөгөөд харин массаас нь бага хамаардаг учраас изотопууд нь химин шинжээрээ бараг ижил байдаг . Харин устөрөгчийн изотопууд бусад элементүүдийнхийг бодвол химийн шинжээрээ нэлээд ялгаатай байдаг. Атомын массыг английн физикч Астон 1919 онд бүтээсэн масс-спектрометргэдэг багаж ашиглан тодорхойлдог . Масс-спектрометрт атом ба молекул нь ион болон хувирч тэр нь цэнэг ба массын харьцаанаасаа (е/м) хамаарч соронзон оронд харилцан адилгүй хэмжээгээр хазайсныг ялган бүртгэж тооцоолдог. Химийн элементийн дундаж атом массыг тодорхойлохдоо байгаль дахь изотоп бүрийн эзлэх хувь ба массын тооны үржвэрийн дунджийг авдаг. Түүнийг м.а.н-д харьцуулж харьцангуй атом массыг нь олдог.
Жишээ нь: Неон нь 8,82%.22.0=1,940 0,25%.21.0=0.055
90,92%.20.0=18.184 бүгд 100%.20.18
Неоны дундаж атом масс нь 20.18 м.а.н харьцангуй атом масс /х.а.м/ нь20.18 байна. Атомын цөм нь өөрчлөгдөхийг цемийн урвал гэнэ. Химийн элементүүд нь цөмийн цэнэг буюу цөм дэх протоны тоогоороо ялгагддаг учраас түүнийг нь өөрчилбөл өөр элемент болж хувирдаг. Зарим элементийн атом нь хэвийн байдалдаа тогтворГүй бөгөөд аяндаа задарч түүнээс хөнгөн цөм бүхий атом үүсч энэ үедээ протон, нейтрон, электрон, болон энерги ялгаруулдаг. Үүнийг цацраг идэвхт задрал, ингэж задардаг элементийг цацраг идэвхт элемент гэнэ. Цацраг идэвхт задралын хугацаа харилцан адилгүй байдаг. Түүнийг хагас нь задрах хугацаагаар нь / хагас задралын үе/илэрхийлдэг. Цөмийн урвалыг зохиомлоор явуулж шинэ элемент ба изотопыг гарган авч болдог.
Одоогоор 10 гаруй элемент, олон тооны изотопыг цөмийн урвал явуулдаг тусгай багаж болох цөмийн реакторт зохиомлоор гарган авч шинжлэх ухаан , техникийн олон салбарт өргөн ашиглаж байна. Цөмийн урвалыг цөгиийн урвалын тэгшитгэлээр илэрхийлдэг. Жишээ нь: 23892Uизотопыг нейтроноор бөмбөгдөхөд 23992U гэсэн изотоп үүсэх бөгөөд тэр нь аяндаа задарч электрон ялгаруулан нептуни гэдэг шинэ элемент , тэр нь цааш задарч плутони гэдэг өөр нэг шинэ элемент үүсгэдэг . Эдгээр хувирлыг тэгшитгэлээр үзүүлбэл:
23892U+10n-~>23S92U 23992U--> 23993 Np+V
eeNp—* 23994Pu+°.ie
Цацраг идэвхжлийг Вильсоны камерт илрүүлж Гейгер-Мюллерийн тоолуурзэрэг багажаар хэмждэг . Мөн бага масстай элементийн изотопуудыг нэгдүүлж болдог . Энэ үед хүнд изотопуудын задралаас олон ia.-.'- ,'х энерги ялгардаг учраас халуун цөмийн урвал гэж нэрлэдэг.
Жишээ нь: 221Н----- →32Не+10n
2 21Н------→31Н+11Н
Хоёрдахь урвалаар ялгарах энерги нь 3,89.1011ж/моль байдаг
Цөмийн масс нь түүнд байгаа протон ба нейтроны массын нийлбэрээс арайбага байдаг . Энэ массын ялгааг массын дефект гэдэг бөгөөд цөмийнхолбооны энергид хувирсан байдаг. Энэ холбооны энерги нь цөм задарч тусдаа нуклонууд үүсэхэд зарцуулагддаг . Масс ба энергийн холбоогЭйнштейний тэгшитгэлээр илэрхийлдэг.
Цөмийн масс нь түүнд байгаа протон ба нейтроны массын нийлбэрээс арайбага байдаг . Энэ массын ялгааг массын дефект гэдэг бөгөөд цөмийнхолбооны энергид хувирсан байдаг. Энэ холбооны энерги нь цөм задарч тусдаа нуклонууд үүсэхэд зарцуулагддаг . Масс ба энергийн холбоогЭйнштейний тэгшитгэлээр илэрхийлдэг.
Е=т с2
Е-ялгарах энерги
т-массын дефект
с-гэрлийн хурд
Цөмийн энергийг ашиглан атомын цахилгаан станц байгуулж , цөмийн зэвсэг хийж байна.
АСУУЛТ, ДАСГАЛ, ДААЛГАВАР
1.Дараах процессын аль нь энерги шингээх вэ?
а.Электроноос электрон салгах
б.Протоноос электрон салгах
в.Протоноос протон салгах
г.Саармаг атомаас электрон салгах
2. Атом ба түүнээс үүссэн катионы аль нь электрон алдахдаа бага энерги зарцуулдаг вэ?
3. Литийн атомын цөмийн цэнэг нь устөрөгчийнхөөс гурав дахин их байхад масс нь яагаад долоо
дахин их байдаг вэ?
4. Хөнгөн цагааны атомын диаметр 3.10"* см байхад цөмийнх нь диаметр 2.10"13см байдаг бол
атом нь цөмөөсөө хэддахин ихдиаметртэй байх вэ?
5. Зэсийн атомын диаметр 2.6 .10"8 см бөгөөд түуний загварыг 5,2 см диаметртэй хийсэн бол
диаметрийг нь хэддахин томруулж хийсэн бэ?
6. Байгаль дахь гели хоёр изотоптой бөгөөд ихэнх нь 4 гэсэн массын тоотой. Маш бага нь 3 гэсэн
массын тоотой байдаг. Изотоп тус бүрийн а.дэсдугаар б.протоны тоов.нейтроны тоо
г. Цөмийн цэнэгийг бич.
7. 0.754 моль35С1. 0.246моль 37CI тус бүр ямар масстай байх вэ?
Байгаль дахь хлор дээрх хоёр изотопын тимм харьцаатай холимог байдаг бол түүний х.а.м-ыг ол
ТЕСТ
1.Атом нь нарийн нийлмэл бүтэцтэй болохыг хэдрвад тогтоосон бэ?
a. XVIII зуунд б. XIX зууны эхзэр
в. XIX зууны сүүлч.ХХ зууны эхээр г. XXзуунд
2.Дараахь бөөмсийн аль нь эхлээд нээгдсэн бз?
а.протон б.нейтрон в. Электрон г.нэгэн зэрэг
З.Катодын туяаг анх хэн нээсэн бэ?
а.У.Крукс б.Ж.Томсон в.Милликен г.Г.Гейгер
4.Электроныг анх хэн нээсэн бэ?
а.У.Крукс б.Ж.Томсон в.Г.Гейгер г.Э.Марсден
5.Электроны цэнэгийн хэмжээг анх хэн тодорхойлсон бэ?
а.Ж.Томсон б.Милликен в.Э.Резерфорд г.Г.Мозли
б.Дараахь туяаны аль нь цахилгаан соронзон долгион бэ?
а.альфа б. бета в.катодын г.рентгөн
7.Дараахь эгэл бөөмсийн аль нь масс ихтэй вэ?
а. Протон б. Электрон в. адилхан
8.Дараахь эгэл бөөмсийн аль нь масс багатай вэ?
а.протон б.нейтрон в.электрон г. Бүгд адил
9.Дараахь зүйлсийн аль нь бусдаасаа ялгаатай вэ?
а.электрон б.протон в.катодын туяа г.бета туяа
10.Атомын цөмд эерэг цэнэгтэй масс ихтэй бөөм байгааг анх хэн тодорхойлсон бэ?
а.Ж.Томсон б.Э.Резерфорд в. Г.Мозли г. Ж.Чедвик
11.Үелэх систем дэх элементийн дэс дугаарын өсөлттэй атомынх нь цөмийн цэнэгийн өсөлт тохирдог
болохыг анх хэн тогтоосон бэ?
а.Э.Резерфорд б. Г.Мозли в. Ж.Чедвик г. Астон
12.Нейтроныг анх хэн нээсэн бэ?
а.Э.Резерфорд б. Г.Мозли в. Ж.Чедвик г. Астон
13.Масс-спектрометрийг анх хэн зохион бүтээсэн бэ?
а. Г.Мозли б. Астон в. Вильсон г. Мюллер
14.Эгэл бөөмсийн аль нь хамгийн хөнгөн бэ?
а. Протон б. Нейтрон в. Электрон г. Адил
15.Эгэл бөөмсийн аль нь цахилгаан саармаг байдаг вэ?
а. Протон б. Нейтрон в. Электрон г. Бүгд
16.Дараахь уртын нэгжийн аль нь хамгийн богино вэ?
а.миллиметр б.микрон в. Ангстрем г. Нанометр
17.Дараахь массын нэгжийн аль нь хамгийн бага вэ?
а.миллиграмм б.карат в.микрограмм г.массын атом нэгж
18.Хамгийн бага цэнэг юу вэ?
а. 0,1кулон б. 1,0кулон в. Юкулон г. Цэнэгийн эгэл нэгж
19.Атомын радиусыг ямар нэгжээр хэмждэг вэ?
а.микрон б.нанометр в.ангстрем г. миллиметр
20.Атомын массыг ямар нэгжээр хэмждэг вэ?
А.миллиграмм б. карат в.микрограмм г. М.а.н
21.Электроны цэнэг ямар байх вэ?

No comments:
Post a Comment
Сэтгэгдлээ энд үлдээн үү!!! Таны бичсэн сэтгэгдлийг хянаж үзээд хэвлэнэ.